L’Associazione dei pazienti malattie infiammatorie Croniche Intestinali A.M.I.C.I Onlus e l’Italian Group for the study of Inflammatory Bowel Disease (IG-IBD) presentano oggi i dati della Survey sulla conoscenza e l’utilizzo dei farmaci biosimilari presso la Sala Stampa della Camera dei Deputati
PER L’ASSOCIAZIONE DEI PAZIENTI E LA SOCIETÀ SCIENTIFICA È IMPROCRASTINABILE UNA CAMPAGNA DI SENSIBILIZZAZIONE AD HOC ANCHE ALLA LUCE DELL’ARRIVO DI NUOVI FARMACI INNOVATIVI
I biosimilari sono farmaci con garanzie di efficacia, sicurezza e qualità per i pazienti, in grado di consentire un accesso omogeneo alle cure e con un ruolo nodale sulla sostenibilità del sistema sanitario e delle terapie innovative, come sottolineato dall’Agenzia italiana del Farmaco (Aifa) nel recente Position paper.
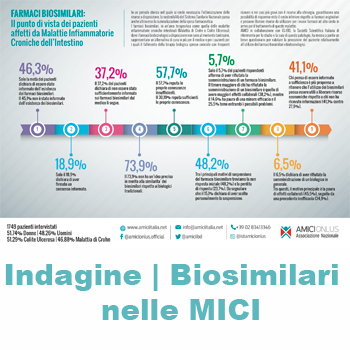
Eppure, poco meno della metà dei pazienti sa che esiste questa opportunità terapeutica (il 46.3%), mentre la stragrande maggioranza o non hai mai ricevuto informazioni sulla loro esistenza o risponde di non sapere (rispettivamente il 45.1% e l’8.5%). Inoltre, ben il 73.9% non ha un’idea precisa in merito alla similarità dei biosimilari rispetto ai farmaci originatori, solo il 10.6% pensa siano uguali, mentre per il 9.2% potrebbero avere una sicurezza minore e il 12% un’efficacia ridotta.
E così questi farmaci continuano a rimanere una cenerentola nel panorama delle terapie: appena il 15.7% dei pazienti è in trattamento con un biosimilare e un 14.2% lo è stato in passato.
Non solo la conoscenza su queste terapie è deficitaria, ci sono anche carenze sul fronte della corretta informazione: poco meno di due pazienti su dieci (il 18.9%) in trattamento con farmaci biosimilari dichiarano di aver firmato un consenso informato.
A fotografare lo stato dell’arte sull’esistenza e l’utilizzo dei farmaci biosimilari è una Survey messa a punto dall’Associazione dei pazienti malattie infiammatorie Croniche Intestinali A.M.I.C.I. in collaborazione con l’Italian Group for the study of Inflammatory Bowel Disease (IG-IBD) che ha coinvolto circa 1.800 pazienti (Il 72% sono seguiti in Centri ospedalieri, il 23.4 da Centri Universitari e solo il 4.7 da privati), affetti da Malattie Infiammatorie Croniche Intestinali (MICI), malattia di Crohn e Colite ulcerosa, e provenienti da tutte le Regioni d’Italia.
I dati della Survey. Il quadro emerso mostra molte crepe sul fronte dell’esistenza e della conoscenza dei biosimilari e sulla similarità tra questi e il loro originatore. Per questo il 57.6% dei pazienti coinvolti nella Survey reputa le proprie conoscenze generali sui farmaci biosimilari insufficienti; il 30.1% ritiene comunque siano sufficienti, solo il 9.6% pensa di avere una buona padronanza e il 2.5% la giudica ottima.
Da rilevare che tra i pazienti che pensano comunque di essere stati informati a sufficienza dal medico che li segue (il 41.1%) c’è una maggiore predisposizione a pensare che l’utilizzo dei farmaci biosimilari possa essere utile a liberare risorse economiche rispetto a chi non ha ricevuto informazioni.
La Survey ha poi indagato sul livello di “compliance” verso queste terapie. Solo il 5.7% dei pazienti ha detto “no” alla somministrazione dei biosimilari, tra questi il rifiuto è legato alla paura di avere maggiori effetti collaterali (il 38.2%), al timore di una minore efficacia della terapia (il 14.6%) o per ad entrambe i possibili problemi (il 25.5%). Ma va sottolineato che il 6.5% dei pazienti ha comunque rifiutato, in generale, la somministrazione di un biologico, e i motivi anche in questo caso sono legati alla paura di effetti collaterali (45.5%), ma anche da una precedente inefficacia (34.9%)
“Quello sull’esistenza e l’uso dei farmaci biosimilari è argomento di attuale e fondamentale importanza – ha detto il Dottor Ambrogio Orlando, Responsabile Unità Operativa Semplice Dipartimentale MICI presso l’A.O. Ospedali Riuniti “Villa Sofia-Cervello” di Palermo – in particolare in un momento in cui , alla luce dell’arrivo di nuovi farmaci ad alto costo per la cura di queste malattie, diventa fondamentale e indispensabile liberare risorse per mantenere sostenibile la spesa sanitaria in Italia e nel mondo. Dai dati della Survey sono emerse informazioni estremamente utili e fondamentali che devono far riflettere sulle azioni future da intraprendere per migliorare la sensibilità e la conoscenza sull’esistenza e l’uso dei farmaci biosimilari. Un utilizzo ancora molto basso rispetto, per esempio, ad altri paesi del Nord Europa che hanno raggiunto tassi di utilizzo dell’80-90 %. Ritengo quindi – prosegue – sia indispensabile a intraprendere una campagna di sensibilizzazione mirata sull’argomento coordinata e condivisa dall’Associazione dei pazienti e la Società scientifica di rifermento per migliorare le conoscenze dei pazienti, in vista anche all’imminente arrivo sul mercato di altri farmaci biosimilari per la cura delle malattie infiammatorie croniche intestinali”.
Nell’ambito della presentazione dei dati della Survey, l’IG-IBD la Società scientifica di riferimento per la gestione dei pazienti affetti da MICI ha sottolineato la sua posizione sull’utilizzo dei farmaci biosimilari, ricordando che “un farmaco biosimilare va considerato equivalente all’originatore in termini di efficacia e sicurezza, laddove tale equivalenza sia supportata dagli studi effettuati secondo le regole stabilite da EMA. Di conseguenza anche l’estrapolazione a diverse indicazioni risulta accettabile quando il biosimilare sia stato provato in una o più delle condizioni in cui il l’originatore risultava approvato e laddove le agenzie regolatorie lo approvino in tali indicazioni terapeutiche”.
“La conoscenza dei farmaci biosimilari da parte dei pazienti deve essere favorita attraverso processi di educazione e di informazione aggiornata, in modo da favorire una scelta informata, anche in accordo con le associazioni dei pazienti stessi – sottolinea il Professor Alessandro Armuzzi, Segretario Generale di IG-IBD – la sicurezza di un farmaco biosimilare approvato dall’Ema va considerata equivalente a quella del farmaco originatore, pur rimanendo necessari studi osservazionali di larghissima taglia per monitorizzarla nel lungo termine. Laddove sia stata confermata la biosimilarità, ogni biosimilare può essere considerato intercambiabile con l’originatore. Di conseguenza, il passaggio (switch) dal farmaco originatore al biosimilare della stessa molecola è accettabile. Al contrario, lo switch da un biosimilare a un altro ed i multipli passaggi andrebbero evitati, in assenza di dimostrazioni dirette e specifiche di efficacia e sicurezza. La sostituzione automatica della prescrizione – aggiunge l’esperto – deve invece essere evitata. Dato che il medico è l’unico responsabile della prescrizione di un farmaco biotecnologico, questa responsabilità non può essere avocata ad altri stakeholder. Lo switch da un originatore a un biosimilare deve avvenire previo un adeguato processo di informazione e consenso da parte del paziente”.
